L'autoprotolisi è una particolare reazione nella quale viene trasferito un protone fra due molecole identiche, una delle quali si comporta come un acido di Brønsted e l'altra come una base di Brønsted. Se una molecola non contiene idrogeno, non può essere soggetta ad autoprotolisi, ma averlo può non essere sufficiente. Una condizione sufficiente è che la molecola sia protica.
Un esempio tipico di autoprotolisi è costituito dalla reazione di autoionizzazione dell'acqua:
- ,
la cui costante di equilibrio ha la forma:
- .
Considerando costante l'attività dell'acqua (55.5 M), si ottiene:
- .
Equilibri di autoprotolisi analoghe esistono anche in altri liquidi, come nell'ammoniaca liquida:
- ,
la cui costante di equilibrio ha la forma:
- .
Altri esempi di equilibri di autoprotolisi sono l'acido fluoridrico, l'acido nitrico, l'acido fosforico, l'acido solforico, l'acido perclorico, ma anche l'acido formico e gli acidi carbossilici in genere, e altri.
Note
Bibliografia
- Paolo Silvestroni, Fondamenti di chimica, CEA-Zanichelli Editore, 1999, p. 1007, ISBN 88-408-0998-8.
Collegamenti esterni
- (EN) autoprotolysis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.


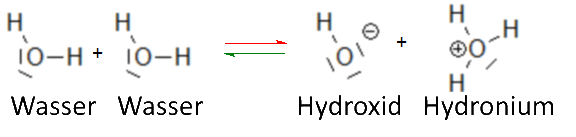

![Protolyse • Protolysereaktion und Autoprotolyse · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/002/209/06db4109d3b333908d8d4403c4163bf6b495e49b/Thumbnail_Protolyse.png?1601035358)